Maco Gyver a pašeráci umelých hnojív – riešenie
10. Jún, 2009, Autor článku: Benko Ján, Prírodné vedy
Ročník 2, číslo 6  Pridať príspevok
Pridať príspevok
 V predošlej časti sme nechali Maca Gyvera samého na lodi bez pitnej vody. No Maco nie je žiadna blekocina, takže ovláda umenie survivalu. S odstupom času nám prezradil ako sa mu podarilo prežiť v tejto životu nebezpečnej situácii…
V predošlej časti sme nechali Maca Gyvera samého na lodi bez pitnej vody. No Maco nie je žiadna blekocina, takže ovláda umenie survivalu. S odstupom času nám prezradil ako sa mu podarilo prežiť v tejto životu nebezpečnej situácii…
Tu je Macova rekonštrukcia:
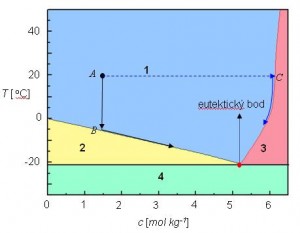
Morská voda obsahuje v prevažnej miere chlorid sodný, preto budeme ako modelový systém uvažovať vodný roztok tejto soli s koncentráciou 0.44 mol.kg-1. Pomery pri ochladzovaní tohto roztoku znázorňuje fázový diagram na obr. 1.
Obr. 1. Fázový diagram roztoku chloridu sodného vo vode. 1 – roztok NaCl, 2 – ľad + roztok NaCl, 3 – nasýtený roztok NaCl + pevný NaCl, 4 – ľad + pevný NaCl
Ak je stav systému, na obr. 1, daný bodom A, má tento dva stupne voľnosti, čo vyplýva z Gibbsovho fázového zákona, rovnica (1).
| (1) |
kde je počet stupňov voľnosti (počet nezávislých premenných veličín, ktoré charakterizujú stav sústavy), k je počet zložiek (minimálny počet látok, z ktorých sa daná sústava skladá), f je počet fáz, 2 – predstavuje dve premenné teplotu a tlak. V našom prípade dej prebieha za konštantného tlaku a rovnica (1) prejde na tvar (2)
| (2) |
Roztok soli vo vode má dve zložky NaCl a vodu. Oblasť 1, tvorí jednu fázu. V tejto oblasti sa môže v určitom intervale meniť teplota a zloženie, bez toho, aby sa počet fáz zmenil. V prípade, že teplota poklesne na hodnotu, pri ktorej dosiahne bod B, začne vypadávať ľad a v systéme sa nachádzajú dve fázy ľad a roztok soli. Tento systém má len jeden stupeň voľnosti, s poklesom teploty ľad postupne vypadáva čím je daná koncentrácia soli v roztoku. Keď teplota dosiahne hodnotu -21.1 oC (eutektický bod) začne vypadávať z roztoku ľad aj soľ, systém nemá žiaden stupeň voľnosti, v tomto bode sa nachádza kvapalný roztok soli vo vode, ľad a NaCl v pevnom skupenstve. Spolu sú to 3 fázy a podľa rovnice (2) systém nemá žiaden stupeň voľnosti. Druhá možnosť je pridávať do roztoku pevný NaCl pri konštantnej teplote. Tento sa bude rozpúšťať, až kým sa nedosiahne bod C, v tomto bode je roztok nasýtený a NaCl sa prestane rozpúšťať. Následným ochladzovaním nasýteného roztoku NaCl, začne vypadávať z roztoku pevný NaCl. Systém má opäť jeden stupeň voľnosti. NaCl postupne vypadáva, až sa dosiahne eutektický bod, v ktorom sa opäť objavia tri fázy a systém nemá žiaden stupeň voľnosti.
Maco Gyver odhadol, že -10 oC je dostatočná teplota na to aby z 1 litra vody získal potrebné množstvo ľadu na núdzové pokrytie pitného režimu na jeden deň. Množstvo získaného ľadu sa dá vypočítať z rovnice (3)
| (3) |
kde K je kryoskopická konštanta vody K=1.86 K mol-1 kg, c je koncentrácia soli, n je počet iónov na ktoré soľ vo vode disociuje (pre NaCl n=2) a je zníženie teploty tuhnutia.
Z kryoskopickej konštanty sa dá vypočítať koncentrácia vodného roztoku NaCl, ktorý má bod tuhnutia -10oC.
| (4) |
Ak v 1 litri je 0.44 molu NaCl, potom množstvo vody potrebné na roztok s koncentráciou 2.69 mol.kg-1 sa dá vypočítať nepriamou úmerou.
| (5) |
to znamená, že pri vymrazovaní 1 litra 0.44 molálneho roztoku NaCl pri -10 oC vypadne 0.84 kg ľadu, ktorý neobsahuje soľ a po roztopení sa dá použiť ako pitná voda.
Literatúra
- K. Andrlík, O. Uher, J. Weigl, K. Dvořák, Chemické tabuľky, Slovenské vydavateľstvo technickej literatúry, Bratislava 1964, str.232


22. Jún, 2011 o 12:09
Skoda ze tu nieje viac informacii :/